
Tecnovigilancia es un Sistema de vigilancia postmercado de dispositivos médicos (DM) que identifica, recolecciona, evalúa, gestiona y divulga los eventos o incidentes adversos que presentan los dispositivos médicos (DM) durante su uso, para mejorar la protección de la salud y la seguridad de los pacientes.
La Tecnovigilancia como actividad trascendental dentro del proceso de evaluación y regulación sanitaria y como complemento de un sistema de calidad en salud, requiere de la conformación del programa institucional que le permitan su adecuado desarrollo, es por esto, que tanto los prestadores de servicios de salud y profesionales independientes habilitados, como los fabricantes e importadores de dispositivos médicos de uso en humanos; deben movilizar esfuerzos por generar los elementos necesarios para su buen desarrollo.
Las instituciones deben designar como mínimo, un profesional competente responsable del Programa Institucional de Tecnovigilancia conforme a lo establecido en el numeral 1, articulo 10 de la Resolución 4816 del 27 de noviembre de 2008 “por el cual se reglamenta el Programa Nacional de Tecnovigilancia” y quien deberá dar cumplimiento a los lineamientos mencionados en los artículos 11° y 12°, de la Resolución en cita; por ello es necesario realizar las siguientes inscripciones ante el INVIMA:
- Registro del profesional designado
https://farmacoweb.invima.gov.co/TecnoVigilancia/faces/index.xhtml
- Inscripción a la Red Nacional de Tecno vigilancia.
https://farmacoweb.invima.gov.co/TecnoVigilancia/faces/inscribirRed.xhtml
- REPORTES DE TECNOVIGILANCIA Ingresar
- CONSULTA ALERTAS SANITARIA E INFORME DE SEGURIDAD – REGISTROS SANITARIOS Ingresar
- GESTIÓN RETIROS DEL PRODUCTO DEL MERCADO, INFORMES DE SEGURIDAD, ALERTAS Y HURTOS Ingresar
- CAPACITACIONES Ingresar
- FORMATOS E INSTRUCTIVOS DE INTERES Ingresar
- DOCUMENTOS DE INTERES Ingresar
- NORMATIVIDAD Y COMUNICACIONES Ingresar

El Programa de Reactivovigilancia, es el conjunto de actividades que tiene por objeto la identificación y cualificación de los efectos indeseados, asociados al uso de los reactivos de diagnóstico in vitro, así como a la identificación de los factores de riesgo o características que puedan estar relacionadas con estos.
El Programa se basa en la notificación, registro y evaluación sistemática de los problemas relacionados con los reactivos de diagnóstico in vitro, con el fin de determinar la frecuencia, gravedad e incidencia de los mismos para prevenir su aparición.
Las actividades que plantea el programa son:
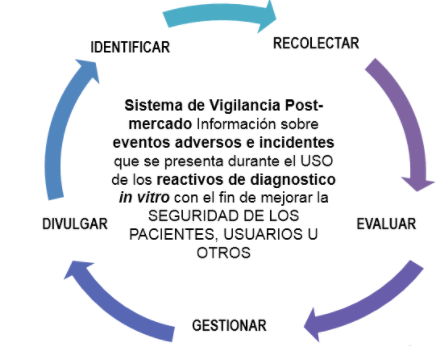
Por lo anterior, las instituciones debe designar como mínimo, un profesional competente responsable del Programa Institucional de reactivovigilancia conforme a lo establecido en el numeral 1, articulo 10 de la Resolución 2020007532 de 2020 “por el cual se modifica el programa nacional de reactivovigilancia” y quien deberá dar cumplimiento a los lineamientos mencionados en los artículos 11° y 12°, de la Resolución en cita; por ello es necesario realizar las siguientes inscripciones ante el INVIMA:
- Registro del profesional designado en plataforma web
- Inscripción a la Red Nacional de Reactivovigilancia.
Asi mismo para el diligenciamiento de los diferentes instrumentos definidos para el sistema de vigilancia de poscomercializacion, se pueden apoyar en el manual de reactivovigilancia web. Manual Reactivovigilancia Web
REPORTES DE REACTIVOVIGILANCIA Ingresar
CONSULTA ALERTAS SANITARIA E INFORME DE SEGURIDAD – REGISTROS SANITARIOS Ingresar
GESTIÓN RETIROS DEL PRODUCTO DEL MERCADO, INFORMES DE SEGURIDAD, ALERTAS Y HURTOS Ingresar
CAPACITACIONES Ingresar
FORMATOS E INSTRUCTIVOS DE INTERES Ingresar
DOCUMENTOS DE INTERES Ingresar
NORMATIVIDAD Y COMUNICACIONES Ingresar
VIGILANCIA SANITARIA PRODUCTOS FARMACEUTICOS
Farmacovigilancia
Son las actividades relacionadas con la detección, evaluación, entendimiento y prevención de los eventos adversos o cualquier otro Problema Relacionado con Medicamentos – Problemas Relacionados con Medicamentos – PRM (Resolución 1403 de 2007).
El prestador de servicios de salud debe contar con actividades documentadas de planeación y ejecución que garantizan el seguimiento al uso de medicamentos (Resolución 3100 de 2019).
¿Qué debe contener el programa de Farmacovigilancia?
La Resolución 1403 de 2007 establece que el programa de Farmacovigilancia contendrá un procedimiento con los siguientes pasos:
* Notificación
* Registro
* Procesamiento de eventos
* Análisis clínico de la información
* Envío de reportes a la entidad reguladora correspondiente.
El INVIMA en su página web indica que adicionalmente el documento debe incluir:
* Objeto
* Alcance
* Responsables
* Marco legal
* Definiciones
* El Procedimiento
* Revisión, registro y difusión de alertas del Invima.
Ruta de consulta: Invima / Productos vigilados /Medicamentos y productos biológicos / Biológicos y de síntesis química /vigilancia / Programa nacional de farmacovigilancia / Programas Institucionales de Farmacovigilancia, haga clic aquí
Recuerde que, la Resolución 3100 de 2019 señala que este documento debe ser socializado, implementado y evaluado.
¿Cómo se realiza el reporte de eventos adversos e incidentes relacionados con medicamentos (PRM)?
El reporte se realiza así:
* Las IPS con servicio farmacéutico o vacunación habilitados, deben hacer el reporte en la plataforma VIGIFLOW (circular INVIMA 3000-0526-2021 del 31/08/2021). Los demás prestadores pueden hacerlo desde el enlace E-Reporting en la página del INVIMA.
* El Reporte en Cero NO es obligatorio, ni esta Secretaría recibe estos reportes, pero recuerde que SI es obligatoria la detección, análisis y gestión de eventos adversos (Resolución 3100 de 2019).
¿Qué es VIGIFLOW?
Es un sistema de gestión de notificaciones para reportar problemas relacionados con medicamentos, reacciones adversas, fallos terapéuticos y errores de medicación que afecten la seguridad de los pacientes, haga clic aquí
¿Qué es eReporting?
Es un formulario en línea utilizado para informar al Invima, Centro Nacional de Farmacovigilancia, si se ha tenido o presenciado algún suceso indeseable que asocia o sospecha, puede estar relacionado con el uso de medicamentos, haga clic aquí
Correo de contacto y mesa de ayuda INVIMA: [email protected] y [email protected]



